Research Contents
研究内容
研究の目標
細菌の細胞表層タンパク質の機能発現と秩序維持機構を明らかにする
私たちの研究室では、生体膜を介して生じる様々な生体反応(細胞イベント)に着目して研究を進めています。特に、タンパク質の細胞内での合成、局在化、折り畳み、機能発現及び分解までの諸過程(いわば、「タンパク質の一生」)、及びこれらの過程が不全となった場合のストレス応答が的確に起こるために細胞に備えられている仕組みを解明しようとしています。そのために生化学、遺伝学、構造生物学、生物物理学、さらには新たに開発したタンパク質動態解析手法等を用いてアプローチしています。
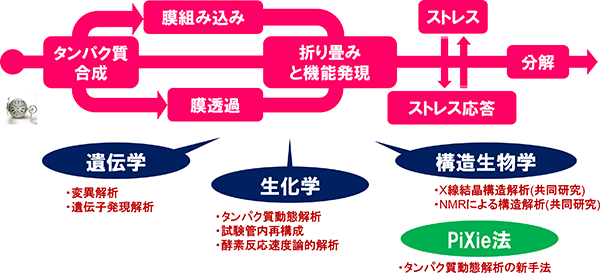
タンパク質の一生~ゆりかごから墓場まで~
研究のテーマ
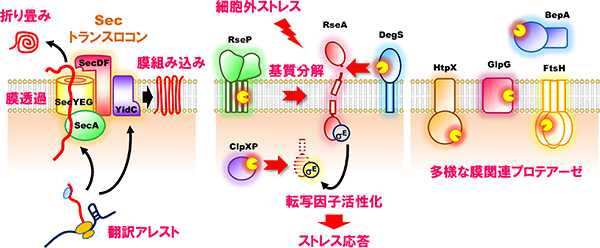
タンパク質膜透過・膜組み込み機構(左)、ストレス応答制御とタンパク質分解の分子機構(中央・右)
研究の内容
-
タンパク質膜透過装置と機能発現機構
-
ストレス応答制御とタンパク質分解の分子機構
-
新たに開発したタンパク質動態解析手法(PiXie法)
Sec 膜透過装置の作動機構の解明
タンパク質が生体膜を横切る反応は、細菌からヒトまで全ての生物に見られる必須の生命現象であり、その反応機構の詳細を理解することは細胞生物学の重要な研究課題の一つといえます。大腸菌などの真性細菌では、SecY, SecE, SecGの3種類の膜内在性タンパク質よりなる「SecYEGトランスロコン」が、タンパク質が通過する為の細い穴(チャネル)を細胞内膜に形成します。このトランスロコンの細胞質側、非細胞質(ペリプラズム)側に各々配置された二種類のモーター因子「SecA ATPase」と「膜タンパク質複合体SecDF」が協調的に働くことで、効率的なタンパク質膜透過が起こると考えられていますが、反応の分子メカニズムは不明な点が多く残されています。我々の研究グループは、高度好熱菌Thermus thermophilus HB8由来のSecDF (T. SecDF) の結晶構造解析により、3.3Å 分解能の立体構造を明らかにし、生化学的な実験結果と併せて、「SecYEGトランスロコンを通過した基質タンパク質は、SecDFの大きなペリプラズムドメインにより補足される。このドメインはプロトンの透過と共役したダイナミックな構造変化を繰り返すことによりタンパク質の膜透過を促進している」というモデルを提案しました(Tsukazaki et al., 2011)。現在我々は、SecDFによる膜透過促進機構のさらなる解明のために研究を続けています。
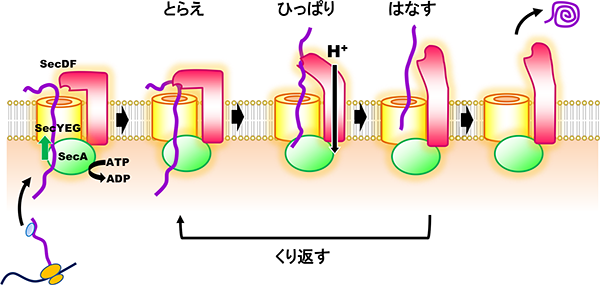
タンパク質の膜透過機構
翻訳アレストを介した膜透過装置の発現制御機構の解明
我々は、ビブリオ属細菌がsecDF遺伝子を二つ有し、一方はNa+(SecDF1)を、もう一方はH+ (SecDF2)を使用して膜透過を促進していることを見出しました(Ishii et al., 2015)。SecDF1は、Na+の豊富な環境では機能しますがNa+濃度の減少に伴い機能も低下します。この時、H+駆動型のSecDF2が発現し、SecDF1の代わりに機能することで細胞のタンパク質膜透過能を維持しています。この様な駆動イオンの異なる膜透過装置の切り替えは、海洋から河口までの幅広い塩濃度下で生息するビブリオ属細菌にとって、環境に適応するための重要な機構の一つと考えています。しかしながら、この二つのSecDFが環境に応じてどのようにしてSecYEGトランスロコンと複合体を形成し、膜透過装置として機能しているかは明らかとなっておらず、現在我々は、二つのSecDFパラログの細胞内での動態を明らかにしようとしています。
また、この細胞の膜透過能の低下に伴ったSecDF2の発現には、secDF2と同一オペロン上の上流遺伝子vemPの翻訳の(一時的な)停止(翻訳アレスト)が関わっていることを明らかにしました(Ishii et al., 2015, Mori et al., 2018)。翻訳アレストはVemPの合成途上鎖がリボソーム出口トンネルの内壁にあるリボソームRNAやタンパク質と相互作用することにより引き起こされますが、膜透過などの外的な力によってそれらの相互作用が強制的に解消され翻訳が再開します。一方で、低NaClなどの膜透過が阻害される状況では翻訳アレストは解除されず、VemP翻訳途上のリボソームが安定化されますが、これによりmRNAの二次構造が壊され、二次構造によりマスクされていたsecDF2のリボソーム結合領域(SD配列)が開放されてリボソームが認識可能となることで、SecDF2の発現(翻訳)が促されると考えています。現在我々は、膜透過による翻訳アレスト解除の詳細な分子機構や翻訳アレスト時の発現促進モデルを証明すべく、研究を行っています。
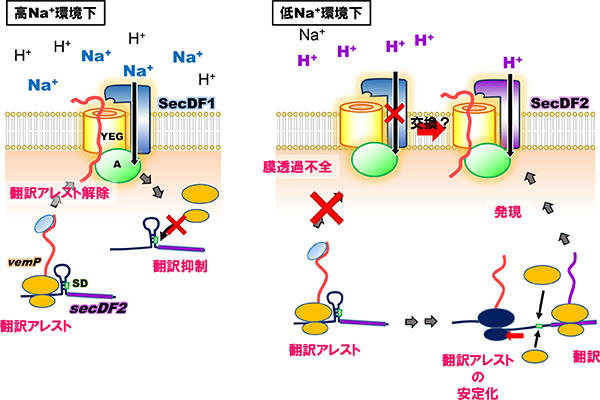
ビブリオ属細菌の翻訳アレストを介した異なる食塩環境への適応
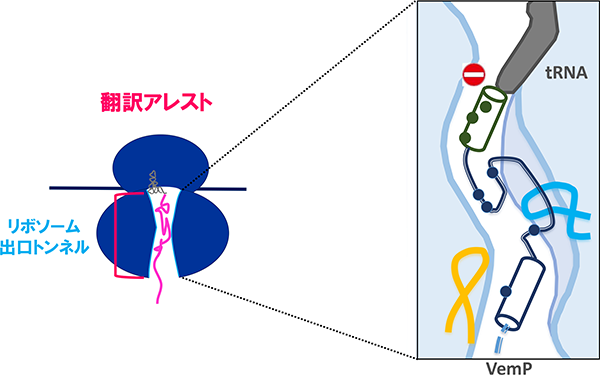
VemPのリボソーム出口トンネル内における翻訳アレストの安定化状態
ストレス応答制御とタンパク質分解の分子機構
膜タンパク質は、生体膜を形作る基本的構成因子であるとともに、機能分子として膜を越えた情報や物質の移行を媒介することで、生体膜機能に必須の役割を果たしています。膜タンパク質の分解は、このような膜の構造や機能、ひいては細胞の生存にとって脅威となりうる異常・不要な膜タンパク質の除去(品質管理)に重要です。一方で、標的となる膜タンパク質を特異的に切断することでその機能を調節したり、膜を介した情報伝達を担うといった、積極的に機能発現に関わるタンパク質分解も存在することが知られています。私達は大腸菌膜タンパク質を対象に、これら両面について研究を行っています。以下に私達が解析対象としているプロテアーゼを紹介します。「制御された膜内部でのタンパク質分解(=RIP)」は、ヒトから細菌まで幅広く保存された現象であり、コレステロール代謝や発生など多彩な生体イベントに関与します。大腸菌でRIPを担う膜内切断プロテアーゼとして、表層ストレス応答の制御や膜中に蓄積するシグナルペプチドの除去に働くRseP(S2Pホモログ)や、真核生物でミトコンドリア機能やアポトーシスなど様々な細胞プロセスに関与するRhomboidのホモログGlpGの細胞機能やその制御、膜タンパク質基質に対する切断メカニズムなどについて研究を進めています。細胞がストレスにさらされた際の対抗手段としてのストレス応答や膜タンパク質の品質管理には多くの膜関連プロテアーゼが関与しており、分解装置としてのプロテアーゼやその関連因子にも着目しています。例えば膜タンパク質の品質管理に中心的な役割を果たすプロテアーゼFtsHや、それと協調して機能するプロテアーゼHtpX、そしてこれらと相互作用する制御因子などの働きについて研究を進めています。また、外敵に対するバリアである外膜の品質維持に関与するプロテアーゼBepAは、外膜タンパク質の状態に応じて生合成促進と分解の2つの活性を使い分けています。その機能制御メカニズムについても研究を進めています。
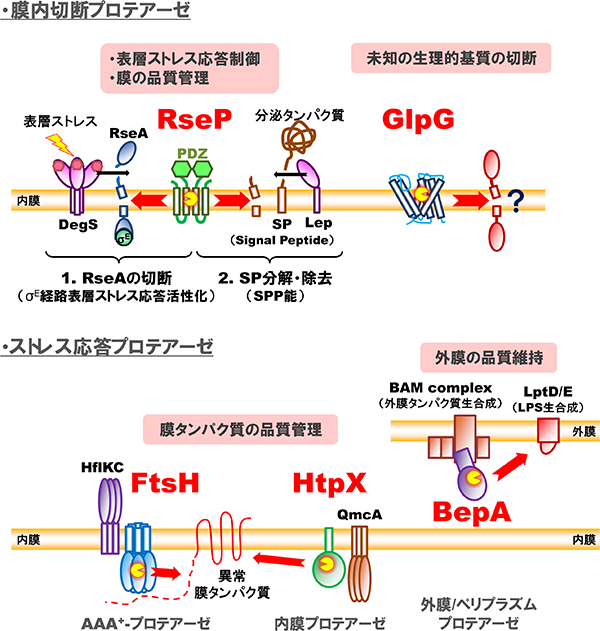
研究対象の膜関連プロテアーゼ
膜内切断プロテアーゼの機能制御機構の解明
細菌膜内切断プロテアーゼであるRsePは、多様な膜貫通タンパク質を基質として切断することで細胞に重要な機能を発揮します。その主要な役割の一つが細菌の生存戦略の一端を担う表層ストレス応答の活性化です。細菌は高温や酸などの外環境変化にさらされた時に、ダメージを受けた細胞膜や細胞表層タンパク質を修復あるいは除去することでその品質を一定に維持し、ストレスに対処する表層ストレス応答機構を持っています。そのうちの主要な経路の一つ、σE経路表層ストレス応答では、熱やアルカリといった表層ストレスによる異常な外膜タンパク質(OMP)やリポ多糖(LPS)の蓄積がトリガーとなり、通常時は膜貫通型の抗σタンパク質RseAに結合することで不活性化されている転写因子σEが活性化され、プロテアーゼやシャペロンなどのストレス応答遺伝子群の転写を促進することでストレスに対処します。σEの活性化には2つの膜プロテアーゼDegSとRsePが関与し、ストレス刺激に応じてまずDegSが一段階目切断としてRseAをペリプラズム側の膜近傍で切断し、続いてRsePが膜内部でRseAを切断することでその切断断片を膜から細胞質へと遊離させ、最終的にσEはリリースされて活性化します。RseAの二段階目の切断を担うRsePは、通常、完全長のRseAを切断できず、DegSによって切断を受けたRseA分解中間体のみを切断します。このような厳密な二段階切断によって表層ストレス応答が制御されています。
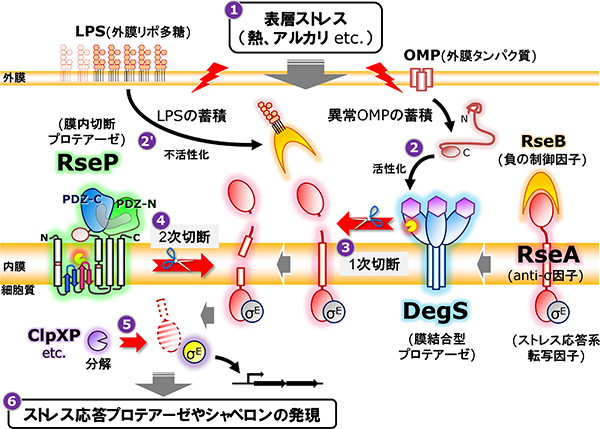
σE経路表層ストレス応答
私たちは厳密に制御されたσE経路表層ストレス応答の活性化において、RsePがどのようにRseAの状態を識別して切断するのか、という基質選別機構や、切断すべき基質をどのように認識して結合し、加水分解するのか、という基質切断反応の詳細な分子機構について興味を持ち、解析を進めています。最近の構造学的、生化学的、遺伝学的解析から、RseAの二段階切断制御にはRsePのペリプラズム領域上に並んで存在する2つのPDZドメイン(PDZタンデム)が関わることが示されました。また、PDZタンデムがサイズ排除フィルターとしての機能を持ち、DegSによる切断で「ペリプラズム領域のサイズが減少したRseA」のみを脂質二重層内部のRseP活性部位へ基質として取り込むことで基質を選別する、というモデルを提案しました(Hizukuri et al., 2014)。また、これに加えて、プロテアーゼドメイン内の触媒部位近傍に位置する膜内挿入ループ領域 (MREβ-loop)が、それに隣接するC1N領域と協調し、基質の膜貫通領域と相互作用することでその二次構造変換を引き起こし、加水分解可能な状態に変化させること、そして構造変換可能かどうかによって切断しうる基質を選別していることを明らかにしました(Akiyama et al., 2015; 2017)。以上のようにRsePのプロテアーゼ機能制御の分子機構に対する理解は進んできましたが、その完全な理解には至っていません。現在、機能や構造に関与しうる未解明のドメインの解析、未知の切断基質やその切断に伴う新たな生理的機能の探索、酵素反応速度論的解析や化学量論的解析などの生化学的アプローチ、蛍光イメージングによるRsePや基質タンパク質の細胞内動態解析などの生物物理学的アプローチといった新たな解析にも取り組んでいます。
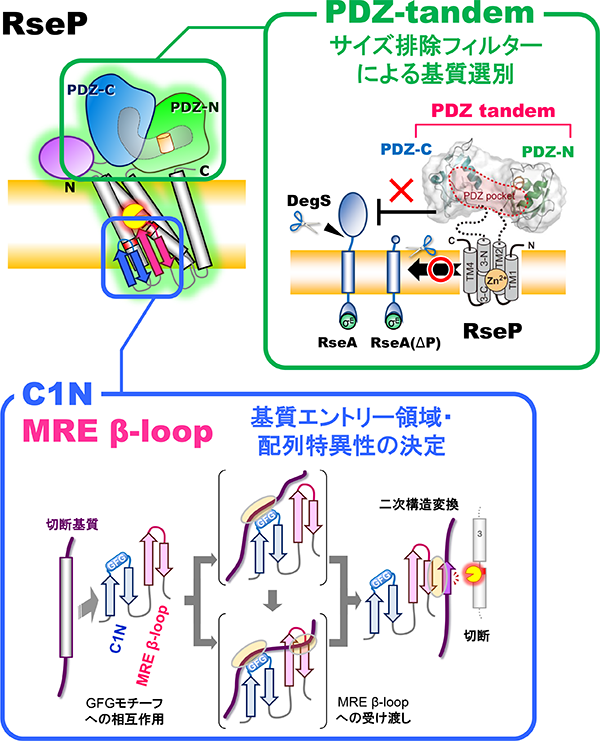
RsePの基質切断における各ドメインの役割
細菌外膜の品質維持機構の解明
グラム陰性細菌の外膜に存在するリポ多糖(LPS)は、外膜が細菌細胞内への異物の侵入に対するバリアとして働くために重要な機能を担っています。このLPSは、外膜タンパク質LptDによりペリプラズムから外膜に輸送されます。私たちが見出したBepAは、ペリプラズムのメタロプロテアーゼの一つです。近年、我々は、BepAが、そのプロテアーゼ活性により、成熟に失敗したLptDなどの外膜タンパク質を分解すること、このプロテアーゼ活性とは独立して、LptDの分子内ジスルフィド結合の架け替えを促進するシャペロン様機能も持つこと、BepAはBAM複合体(外膜タンパク質組込み装置)と近接していることなどを報告しました(Narita et al., 2013)。また、BepAのC末側に存在するTPRドメインの構造(共同研究)を決定するとともに、このドメインが機能に必須であることや、BAM因子や基質タンパク質との相互作用にも働くことを見出し、その部位を決定して報告しました(Daimon et al.,2017)。我々は、BepAがどのようにして、外膜タンパク質の状態に応じてその生合成促進と分解を行う2つの活性を使い分け、外膜の品質維持に寄与しているかなど、BepAの生理的役割の全容を明らかにすることを研究目的としています。
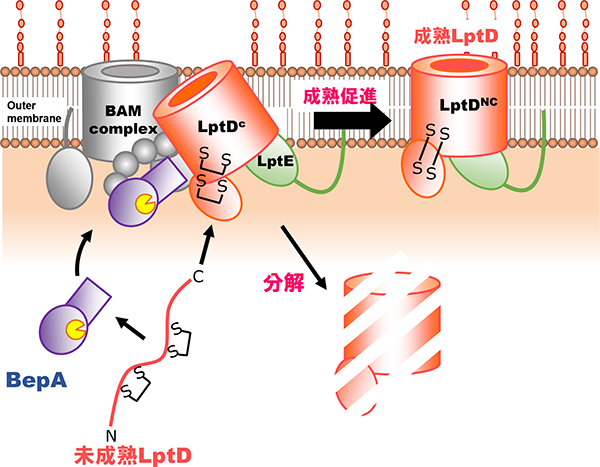
BepAによるLptDのassembly
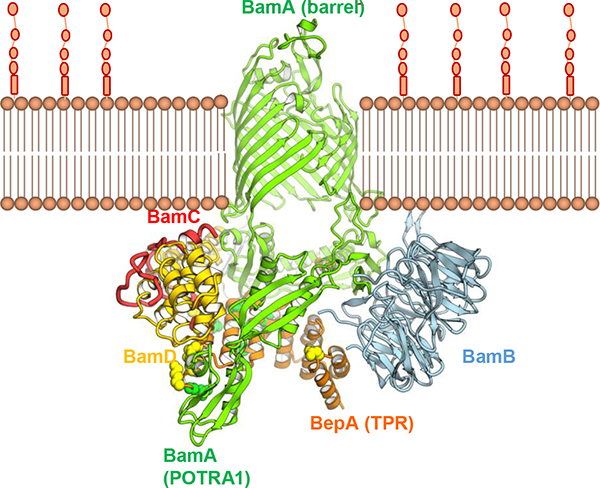
BepAとBAM複合体のドッキングモデル
新たに開発したタンパク質動態解析手法(PiXie法)
タンパク質の機能を解明するには、実際にタンパク質が働く細胞内での動的な振る舞いを解析することが重要です。当研究室では、「部位特異的in vivo光架橋法」というユニークな手法を用いて、その解析を行っています。部位特異的in vivo光架橋法とは、pBPA等の光反応性のクロスリンカーを側鎖に有する非天然アミノ酸を用いた手法です。amber suppressionを利用し、任意の部位にpBPAを導入したタンパク質を細胞内で発現させて架橋実験を行うことで、生細胞内での標的タンパクの相互作用・フォールディングをアミノ酸レベルの高い空間分解能で解析することが可能となります。我々はこの手法を改良し、高い時間分解能を有するパルス・チェイス法と組み合わせた新たな手法、PiXie(pulse chase and in vivo photo-cross-linking experiment)法を構築しました。そして、PiXie法によって、生きた細胞内で新規合成されたタンパク質のダイナミックな成熟(フォールディング・アセンブリー)過程を分子レベルで解析できることを実証しました(Miyazaki et al., 2018)。現在は、PiXie法を活用して、複数の因子が関わる複雑なタンパク質の成熟過程やリボソームに翻訳されている途中のタンパク質の相互作用機構等の研究を進めています。
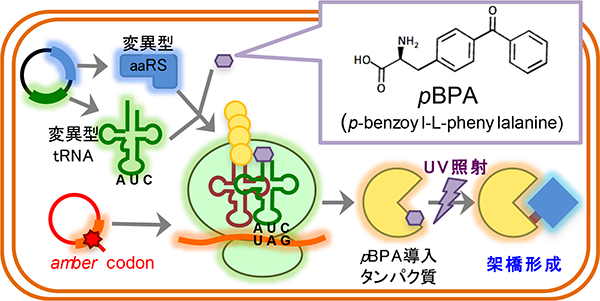
部位特異的in vivo 光架橋法
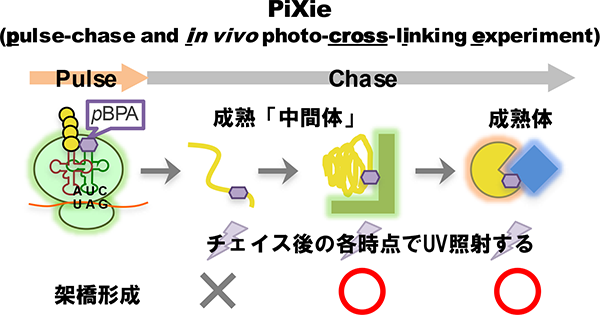
PiXie法

